九年级化学第八单元核心知识点有哪些?
校园之窗 2025年12月12日 05:30:48 99ANYc3cd6
九年级化学第八单元:金属和金属材料
本单元的核心是金属的物理性质、化学性质、金属活动性顺序、金属的冶炼和资源保护。
金属的物理性质
-
共性:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 状态:常温下,大多数为固体(汞是液体)。
- 颜色:多数为银白色(铜为紫红色,金为黄色)。
- 光泽:有金属光泽。
- 导电导热性:都是电和热的良导体。
- 延展性:都具有良好的延性(拉成细丝)和展性(压成薄片)。
-
差异性:
- 密度:不同金属密度不同(如钨密度大,铝密度小)。
- 熔点:不同金属熔点不同(如钨熔点高,锡熔点低)。
- 硬度:不同金属硬度不同(如铬硬度大,钠硬度小)。
-
决定物理性质的因素:金属的物理性质主要取决于金属原子的结构(内部自由电子的运动)。
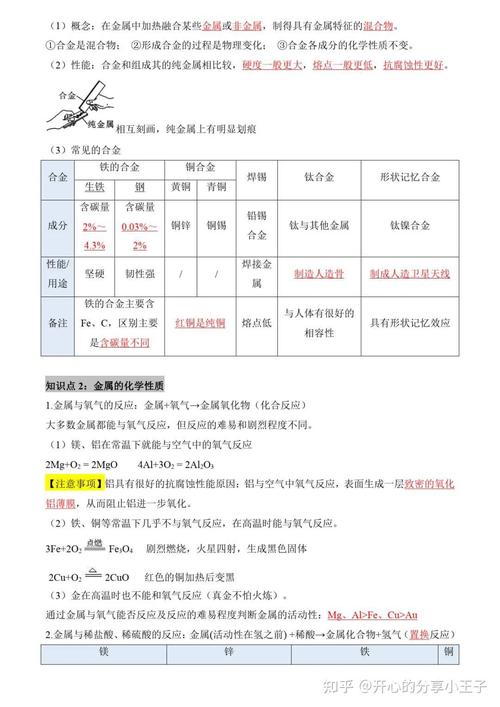
合金
- 定义:在金属中加热熔合某些其他金属或非金属,形成的具有金属特性的物质。
- 特点:
- 合金的硬度一般比组成它的纯金属大。
- 合金的熔点一般比组成它的纯金属低。
- 合金的抗腐蚀性能更好。
- 常见合金:
- 铁合金:
- 生铁:含碳量 2%~4.3%,硬度大,但较脆,不易铸造和机械加工。
- 钢:含碳量 03%~2%,坚硬、有韧性、塑性好,具有弹性,机械性能好,用途广泛。
- 铝合金:强度和硬度好,轻,用于制造飞机、门窗等。
- 铜合金:
- 黄铜(铜锌合金)
- 青铜(铜锡合金)
- 铁合金:
金属的化学性质
这是本单元的核心考点,需要重点掌握反应的现象、化学方程式和相关应用。
-
金属与氧气的反应
 (图片来源网络,侵删)
(图片来源网络,侵删)- 镁、铝:在常温下就能与氧气反应,表面形成一层致密的氧化膜,起到自我保护作用。
4Al + 3O₂ = 2Al₂O₃(现象:铝表面变暗,形成保护膜)
- 铁、铜:在常温下几乎不与氧气反应,在潮湿空气中会缓慢氧化而生锈。
3Fe + 2O₂ --点燃--> Fe₃O₄(现象:剧烈燃烧,火星四射,生成黑色固体)2Cu + O₂ --加热--> 2CuO(现象:铜丝表面变黑)
- 金、铂:即使在高温下也不与氧气反应,化学性质非常稳定。
- 镁、铝:在常温下就能与氧气反应,表面形成一层致密的氧化膜,起到自我保护作用。
-
金属与酸的反应(置换反应)
- 反应条件:排在氢前面的金属才能置换出酸中的氢。
- 反应规律:
金属 + 酸 → 盐 + 氢气 - 常见反应:
Zn + H₂SO₄ = ZnSO₄ + H₂↑(现象:锌粒表面产生大量气泡)Fe + 2HCl = FeCl₂ + H₂↑(现象:铁表面产生气泡,溶液由无色变为浅绿色)Mg + H₂SO₄ = MgSO₄ + H₂↑(现象:反应剧烈,产生大量气泡)
- 注意:铜排在氢后面,不与稀硫酸、稀盐酸反应。
-
金属与盐溶液的反应(置换反应)
- 反应条件:活动性强的金属可以把活动性弱的金属从它们的盐溶液中置换出来。
- 反应规律:
金属A + 盐B → 金属B + 盐A - 常见反应:
Fe + CuSO₄ = FeSO₄ + Cu(现象:铁表面附着一层红色固体,溶液由蓝色变为浅绿色)Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag(现象:铜丝表面附着一层银白色固体,溶液由无色变为蓝色)
- 注意事项:
- 钾、钙、钠等非常活泼的金属,投入盐溶液中,先与水反应,生成的碱再与盐反应,不发生简单的金属置换。
- 铁参加此反应,生成物是亚铁盐(Fe²⁺),不是铁盐(Fe³⁺)。
金属活动性顺序
-
顺序表:
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au (图片来源网络,侵删)
(图片来源网络,侵删) -
意义和应用:
- 判断金属与酸能否反应:排在H前面的金属能与酸反应置换出氢;排在H后面的金属不能。
- 判断金属与盐溶液能否反应:排在前面的金属能把排在后面的金属从其盐溶液中置换出来(K, Ca, Na除外)。
- 判断金属活动性强弱:位置越靠前,金属活动性越强。
- 判断金属与盐溶液反应后溶液质量的变化:
- 增重:放入的金属原子量 > 替换出的金属原子量(如:Fe放入CuSO₄溶液中)。
- 减重:放入的金属原子量 < 替换出的金属原子量(如:Cu放入AgNO₃溶液中)。
金属资源的利用和保护
-
铁的冶炼
- 原料:铁矿石(赤铁矿 Fe₂O₃、磁铁矿 Fe₃O₄)、焦炭、空气、石灰石。
- 设备:高炉。
- 原理:在高温下,利用一氧化碳将铁从其氧化物中还原出来。
- 主要反应:
Fe₂O₃ + 3CO --高温--> 2Fe + 3CO₂(现象:红色粉末逐渐变黑,生成能使澄清石灰水变浑浊的气体)
- 主要反应:
- 注意:炼出的是生铁,不是纯铁。
-
金属的锈蚀与防护
- 铁锈蚀的条件:铁与氧气和水(或水蒸气)同时接触。
- 防锈原理:隔绝氧气或水。
- 常用防锈方法:
- 保持干燥和洁净。
- 形成保护膜:如刷油漆、涂油、电镀、烤蓝等。
- 制成不锈钢:改变金属的内部结构。
-
金属资源的保护
- 防止金属腐蚀。
- 回收利用废旧金属(金属回收途径之一)。
- 有计划、合理地开采矿物。
- 寻找金属的代用品。
重点、难点、易错点总结
-
重点:
- 金属的化学性质(尤其是与酸、与盐溶液的反应)。
- 金属活动性顺序及其应用。
- 铁生锈的条件和防锈原理。
- 工业炼铁的原理和主要反应。
-
难点:
- 金属活动性顺序的综合应用,特别是设计实验证明金属活动性顺序。
- 理解“铁与盐溶液反应生成亚铁盐”。
- 理解“钾、钙、钠投入盐溶液中的特殊反应”。
-
易错点:
- 化学式写错:如把氯化亚铁写成 FeCl₃,硫酸铜写成 CuSO₄(应写 CuSO₄)。
- 现象描述不准确:如描述铁与硫酸铜反应时,只说“有红色物质生成”,忽略了“溶液由蓝色变为浅绿色”。
- 反应条件忽略:如铁在氧气中燃烧的产物是四氧化三铁(Fe₃O₄),不是氧化铁(Fe₂O₃)。
- 金属活动性顺序应用错误:误认为氢后面的铜可以与盐酸反应,或误将钠放入硫酸铜溶液中认为会置换出铜。
- 防锈原理混淆:认为只要隔绝水或隔绝氧气中的一种即可,实际上需要同时隔绝两者。
希望这份详细的梳理能帮助你更好地掌握第八单元的知识!祝你学习进步!










