九年级化学上册知识点归纳有哪些核心考点?
校园之窗 2025年12月14日 19:59:43 99ANYc3cd6
九年级化学上册知识点总纲
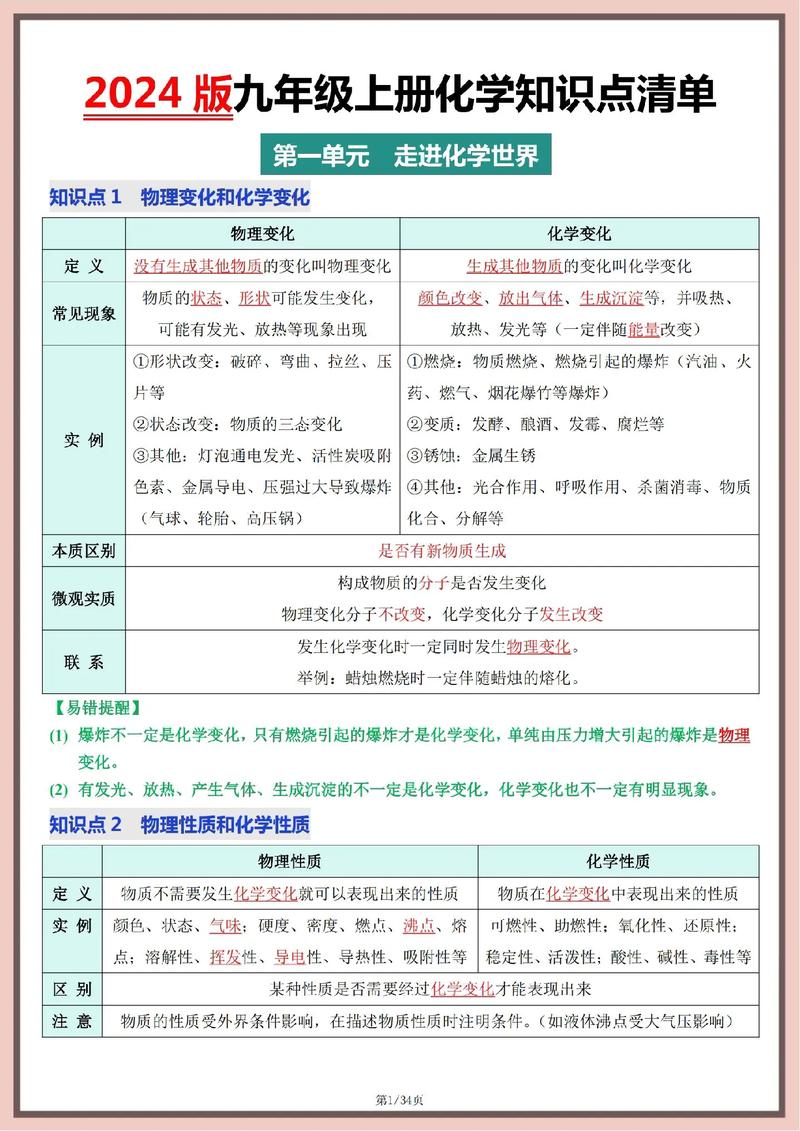
九年级化学上册主要围绕物质构成的奥秘和化学变化的基本规律这两大核心展开,可以大致分为以下几个模块:
- 绪论与基本概念:认识化学,了解化学研究的对象、物质的变化和分类。
- 空气和氧气:认识我们身边的物质,学习氧气的性质和实验室制法,理解纯净物与混合物的概念。
- 构成物质的微粒:从宏观世界进入微观世界,学习分子、原子、离子的概念和构成。
- 自然界的水:了解水的组成、净化和硬水软化,初步认识化学式与化合价。
- 碳和碳的氧化物:学习碳单质及其重要氧化物(CO₂、CO)的性质和用途。
- 燃料及其利用:认识燃烧条件、灭火原理,以及化石燃料和清洁能源。
第一单元 走进化学世界
核心知识点
-
化学的研究对象
 (图片来源网络,侵删)
(图片来源网络,侵删)- :物质的组成、结构、性质、变化规律以及制备。
- 特征:以实验为基础。
-
物质的变化
- 物理变化:没有新物质生成的变化。
- 特征:状态、形状、大小的改变。
- 举例:水结冰、水蒸发、石蜡熔化、矿石粉碎。
- 化学变化:有新物质生成的变化(也叫化学反应)。
- 特征:有新物质生成,常伴随发光、放热、变色、产生气体、生成沉淀等现象。
- 举例:燃烧、生锈、食物腐败、镁条燃烧。
- 本质区别:是否有新物质生成。
- 物理变化:没有新物质生成的变化。
-
物质的性质
- 物理性质:物质不需要发生化学变化就表现出来的性质。
内容:颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性等。
- 化学性质:物质在化学变化中表现出来的性质。
内容:可燃性、助燃性、氧化性、还原性、酸性、碱性等。
 (图片来源网络,侵删)
(图片来源网络,侵删) - 区别:是否需要通过化学变化来体现。
- 物理性质:物质不需要发生化学变化就表现出来的性质。
-
化学实验基本操作
- 药品的取用:
- “三不”原则:不触、不闻、不尝。
- 液体药品:少量用胶头滴管,较多用倾倒法(标签向手心)。
- 固体药品:块状用镊子(“一横二放三慢竖”),粉末用药匙或纸槽(“一斜二送三直立”)。
- 物质的加热:
- 酒精灯:用外焰加热,禁止“对火”点燃,禁止用嘴吹灭(用灯帽盖灭)。
- 加热方法:先预热,后集中加热。
- 加热固体:试管口略向下倾斜。
- 加热液体:试管内液体体积不超过容积的1/3,试管口向上倾斜,与桌面成45°角。
- 仪器的连接与气密性检查:
- 连接:稍用力转动,使玻璃接口处水润湿。
- 检查:将导管末端浸入水中,双手紧贴容器外壁,若导管口有气泡冒出,松手后形成一段水柱,则气密性良好。
- 过滤:分离固体和液体混合物。
- 操作要点:“一贴、二低、三靠”。
- 一贴:滤纸紧漏斗内壁。
- 二低:滤纸边缘低于漏斗边缘;液面低于滤纸边缘。
- 三靠:烧杯口紧靠玻璃棒;玻璃棒紧靠三层滤纸处;漏斗下端管口紧靠烧杯内壁。
- 操作要点:“一贴、二低、三靠”。
- 蒸发:用蒸发皿,边加热边搅拌,当出现大量固体时停止加热,用余热蒸干。
- 药品的取用:
第二单元 我们周围的空气
核心知识点
-
空气的组成
- 体积分数:氮气 (N₂) 约 78%,氧气 (O₂) 约 21%,稀有气体约 94%,二氧化碳 (CO₂) 约 03%,其他气体和杂质约 03%。
- 纯净物与混合物:
- 纯净物:由一种物质组成(如:氧气、氮气)。
- 混合物:由两种或多种物质混合而成(如:空气、海水)。
-
氧气 (O₂) 的性质
- 物理性质:无色无味的气体,密度比空气略大,不易溶于水。
- 化学性质(比较活泼):
- 支持燃烧:具有助燃性。
- 木炭 + 氧气 → 二氧化碳 (C + O₂ --(点燃)→ CO₂),发出白光,放出热量。
- 硫 + 氧气 → 二氧化硫 (S + O₂ --(点燃)→ SO₂),明亮的蓝紫色火焰,生成有刺激性气味的气体。
- 磷 + 氧气 → 五氧化二磷 (4P + 5O₂ --(点燃)→ 2P₂O₅),产生大量白烟。
- 铁丝 + 氧气 → 四氧化三铁 (3Fe + 2O₂ --(点燃)→ Fe₃O₄),剧烈燃烧,火星四射,生成黑色固体。
- 供给呼吸:如潜水、医疗急救。
- 支持燃烧:具有助燃性。
-
氧气的实验室制法
 (图片来源网络,侵删)
(图片来源网络,侵删)- 药品:过氧化氢溶液 (H₂O₂) 和二氧化锰 (MnO₂),或高锰酸钾 (KMnO₄)。
- 反应原理:
- 2H₂O₂ --(MnO₂)→ 2H₂O + O₂↑ (固液不加热型)
- 2KMnO₄ --(加热)→ K₂MnO₄ + MnO₂ + O₂↑ (固固加热型)
- 发生装置:
- 固液不加热型:锥形瓶/试管、长颈漏斗/分液漏斗、导管。
- 固固加热型:酒精灯、试管、铁架台。
- 收集装置:
- 排水法:因为氧气不易溶于水。
- 向上排空气法:因为氧气密度比空气大。
- 检验方法:将带火星的木条伸入集气瓶中,若木条复燃,则是氧气。
- 验满方法:
- 排水法:当集气瓶口有大气泡冒出时,已集满。
- 向上排空气法:将带火星的木条放在集气瓶口,若木条复燃,已集满。
第三单元 物质构成的奥秘
核心知识点
-
分子和原子
- 分子:保持物质化学性质的最小粒子。
特点:质量小、体积小;不断运动;分子间有间隔。
- 原子:化学变化中的最小粒子。
在化学变化中,分子可分,原子不可分。
- 原子结构:
- 原子核 (质子 + 中子) + 核外电子
- 核电荷数 = 质子数 = 核外电子数 (原子中)
- 相对原子质量 ≈ 质子数 + 中子数
- 分子:保持物质化学性质的最小粒子。
-
元素
- 定义:具有相同核电荷数(即质子数)的一类原子的总称。
- 分类:金属元素、非金属元素、稀有气体元素。
- 元素符号:国际通用,由一个或两个字母表示,第一个字母大写,第二个字母小写。
- 元素周期表:根据原子序数(即核电荷数)排列的元素列表。
-
离子
- 定义:带电荷的原子或原子团。
- 形成:原子得到或失去电子。
- 阳离子:原子失去电子,带正电 (如 Na⁺, Ca²⁺)。
- 阴离子:原子得到电子,带负电 (如 Cl⁻, O²⁻)。
- 物质由离子构成:如氯化钠 (NaCl) 由 Na⁺ 和 Cl⁻ 构成。
-
化学式与化合价
- 化学式:用元素符号和数字的组合表示物质组成的式子。
- 意义:①表示一种物质;②表示该物质的元素组成;③表示该物质的一个分子;④表示一个分子的构成。
- 书写规则:正价在前,负价在后;化合物中正负化合价代数和为零。
- 化合价:元素在形成化合物时表现出的一种性质。
- 原则:化合物中正负化合价代数和为零。
- 常见元素化合价口诀:
- 一价氢氯钾钠银,二价氧钙钡镁锌。
- 三铝四硅五价磷,二三铁,二四碳。
- 二四六硫都齐全,铜汞二价最常见。
- 化学式:用元素符号和数字的组合表示物质组成的式子。
第四单元 自然界的水
核心知识点
-
水的组成
- 电解水:正极产生氧气,负极产生氢气,体积比约为 1:2。
- 水是由氢、氧两种元素组成的,化学式为 H₂O。
-
水的净化
- 天然水 → 自来水:沉降、过滤、吸附、消毒(氯气)。
- 硬水与软水:
- 硬水:含有较多可溶性钙、镁化合物的水。
- 软水:不含或含较少可溶性钙、镁化合物的水。
- 检验:用肥皂水,泡沫多浮渣少的是软水,泡沫少浮渣多的是硬水。
- 硬水软化方法:煮沸、蒸馏。
-
爱护水资源
- 措施:一方面要节约用水,另一方面要防治水体污染。
第五单元 碳和碳的氧化物
核心知识点
-
碳的单质
- 金刚石:自然界最硬的物质,用于钻头、切割玻璃。
- 石墨:质软、有滑感、能导电,用于电极、铅笔芯。
- C₆₀:足球烯,由60个碳原子构成。
- 化学性质:
- 常温下稳定。
- 可燃性:C + O₂ --(点燃)→ CO₂ (充分燃烧);2C + O₂ --(点燃)→ 2CO (不充分燃烧)。
- 还原性:C + 2CuO --(高温)→ 2Cu + CO₂↑ (黑色粉末变红色)。
-
二氧化碳 (CO₂)
- 物理性质:无色无味气体,密度比空气大,能溶于水,固体叫“干冰”,易升华吸热。
- 化学性质:
- 不支持燃烧,也不能燃烧(用于灭火)。
- 与水反应:CO₂ + H₂O → H₂CO₃ (碳酸),碳酸不稳定,易分解 H₂CO₃ → CO₂↑ + H₂O。
- 与石灰水反应:CO₂ + Ca(OH)₂ → CaCO₃↓ + H₂O (使澄清石灰水变浑浊,用于检验CO₂)。
- 实验室制法:
- 药品:大理石/石灰石 (主要成分CaCO₃) 和稀盐酸。
- 原理:CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂↑
- 装置:固液不加热型。
- 收集:向上排空气法(因为密度比空气大,且能溶于水)。
- 检验:通入澄清石灰水中,若变浑浊,则是CO₂。
- 验满:将燃着的木条放在集气瓶口,若木条熄灭,已集满。
-
一氧化碳 (CO)
- 物理性质:无色无味气体,密度与空气相近,难溶于水。
- 化学性质:
- 可燃性:2CO + O₂ --(点燃)→ 2CO₂ (蓝色火焰)。
- 毒性:与血液中的血红蛋白结合,使人体缺氧。
- 还原性:CO + CuO --(加热)→ Cu + CO₂ (黑色粉末变红色)。
第六单元 燃烧及其利用
核心知识点
-
燃烧与灭火
- 燃烧条件(同时具备):
- 可燃物
- 与氧气(或空气)接触
- 温度达到着火点
- 灭火原理(破坏任意一个条件):
- 清除可燃物或使可燃物与其他物品隔离
- 隔绝氧气(或空气)
- 使温度降到着火点以下
- 燃烧条件(同时具备):
-
化石燃料
- 三大化石燃料:煤、石油、天然气(主要成分是甲烷 CH₄)。
- 能源危机与开发新能源:氢能、太阳能、风能、地热能等。
-
化学反应中的能量变化
- 放热反应:如燃烧、中和反应、金属与酸反应。
- 吸热反应:如碳与二氧化碳的反应、大多数分解反应。
总结与建议
- 抓核心概念:如“化学变化”、“分子原子”、“元素”、“化合价”等,这些是贯穿整个化学学习的基础。
- 重理解记忆:不要死记硬背,要理解反应原理和现象背后的原因,制取氧气和二氧化碳装置选择的依据。
- 勤动手实验:化学是一门以实验为基础的学科,通过实验可以加深对知识的理解和记忆。
- 建立知识网络:将各个单元的知识点联系起来,形成知识体系,从空气中的氧气到实验室制法,再到氧气的化学性质,形成一个完整的链条。
- 多做练习:通过做题巩固知识点,查漏补缺,特别是化学方程式的配平、实验探究题等。
希望这份归纳对你有帮助,祝你学习进步!