金属的化学性质有哪些常见规律?
校园之窗 2025年12月13日 17:31:00 99ANYc3cd6
九年级化学:金属的化学性质
金属的化学性质主要体现在它们与氧气、酸、盐溶液的反应上,我们可以通过这些反应来比较金属的活动性强弱。
金属与氧气的反应
大多数金属都能与氧气反应,生成对应的金属氧化物,但反应的难易程度和剧烈程度不同,这体现了金属活动性的差异。
(图片来源网络,侵删)
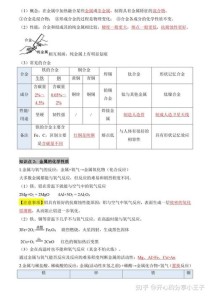
| 金属 | 反应条件 | 实验现象 | 化学方程式 | |
|---|---|---|---|---|
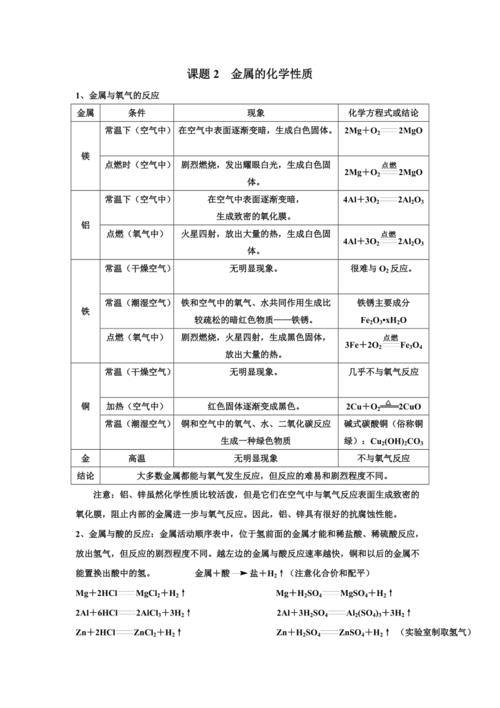
| 镁 | 常温下(在空气中) | 表面会缓慢变暗。 | 2Mg + O₂ = 2MgO |
镁比较活泼。 |
| 点燃(在空气中/氧气中) | 剧烈燃烧,发出耀眼白光,放出大量热,生成白色固体。 | 2Mg + O₂ = (点燃) 2MgO |
||
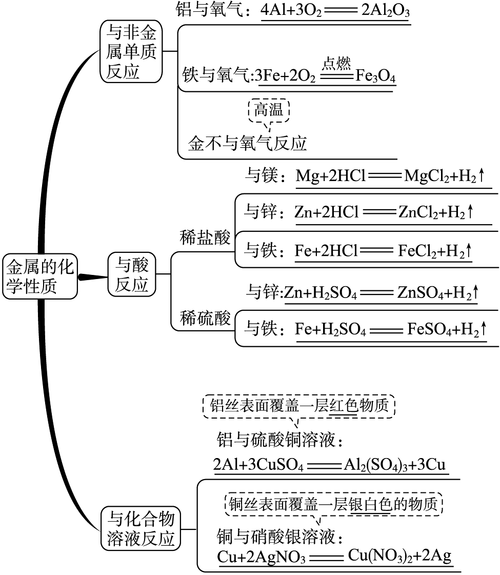
| 铝 | 常温下(在空气中) | 表面会生成一层致密的氧化铝(Al₂O₃)薄膜,阻止内部铝进一步被氧化。 | 4Al + 3O₂ = 2Al₂O₃ |
铝比较活泼,但表面有保护膜,所以耐腐蚀。 |
| 加热(在氧气中) | 剧烈燃烧,发出耀眼白光,生成白色固体。 | 4Al + 3O₂ = (点燃) 2Al₂O₃ |
||
| 铁 | 常温下(在干燥空气中) | 不反应,很稳定。 | - | 铁在干燥空气中稳定,但在潮湿空气中易生锈。 |
| 常温下(在潮湿空气中) | 与氧气、水缓慢反应,生成疏松的红棕色铁锈(主要成分Fe₂O₃·xH₂O)。 | 4Fe + 3O₂ + 2xH₂O = 2Fe₂O₃·xH₂O |
铁的化学性质比镁、铝弱。 | |
| 高温(在氧气中) | 剧烈燃烧,火星四射,生成黑色固体。 | 3Fe + 2O₂ = (点燃) Fe₃O₄ |
||
| 铜 | 加热 | 红色固体逐渐变成黑色。 | 2Cu + O₂ = (加热) 2CuO |
铜的化学性质比较稳定,不如镁、铁活泼。 |
| 金 | 高温/点燃 | 不反应(“真金不怕火炼”)。 | - | 金最不活泼,化学性质非常稳定。 |
核心结论: 金属的活动性顺序:Mg > Al > Fe > Cu > Au (越往前的金属,与氧气反应越容易,越剧烈)
金属与酸的反应
金属活动性顺序表中,氢(H)以前的金属能与稀盐酸、稀硫酸等发生置换反应,生成盐和氢气。
反应规律: 较活泼金属 + 酸 → 盐 + 氢气
| 金属 | 与稀盐酸反应 | 与稀硫酸反应 | 化学方程式(以稀盐酸为例) | 现象描述 |
|---|---|---|---|---|
| 镁 | 剧烈反应 | 剧烈反应 | Mg + 2HCl = MgCl₂ + H₂↑ |
剧烈反应,迅速产生大量气泡,金属溶解,试管外壁发热。 |
| 锌 | 较剧烈反应 | 较剧烈反应 | Zn + 2HCl = ZnCl₂ + H₂↑ |
较剧烈反应,产生大量气泡,金属溶解,试管外壁发热。 |
| 铁 | 缓慢反应 | 缓慢反应 | Fe + 2HCl = FeCl₂ + H₂↑ |
缓慢反应,有气泡产生,溶液由无色变为浅绿色。 |
| 铜 | 不反应 | 不反应 | - | 不反应,无明显现象。 |
重要考点:
(图片来源网络,侵删)
- 反应条件: 只有排在氢前面的金属才能置换出酸中的氢。
- 现象描述:
- 都有气泡产生。
- 金属逐渐溶解。
- 铁与酸反应时,溶液会变为浅绿色(因为生成了亚铁盐,如FeCl₂)。
- 反应放热,试管外壁会变热。
- 金属活动性比较:
- 镁反应最剧烈,锌次之,铁最缓慢。
- Mg > Zn > Fe > Cu (H)
金属与盐溶液的反应
活动性较强的金属可以把活动性较弱的金属从它们的盐溶液中置换出来。
反应规律: 活动性强的金属 + 活动性弱的金属的盐溶液 → 新盐 + 新金属
| 实验操作 | 实验现象 | 化学方程式 | |
|---|---|---|---|
| 铁丝放入硫酸铜溶液中 | 银白色铁丝表面附着一层红色固体,溶液由蓝色变为浅绿色。 | Fe + CuSO₄ = FeSO₄ + Cu |
铁比铜活泼,Fe能把Cu从CuSO₄溶液中置换出来。 |
| 铜丝放入硝酸银溶液中 | 红色铜丝表面附着一层银白色固体,溶液由无色变为蓝色。 | Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag |
铜比银活泼,Cu能把Ag从AgNO₃溶液中置换出来。 |
| 铝丝放入硫酸铜溶液中 | 银白色铝丝表面附着一层红色固体,溶液由蓝色变为无色。 | 2Al + 3CuSO₄ = Al₂(SO₄)₃ + 3Cu |
铝比铜活泼。 |
| 铜丝放入硫酸锌溶液中 | 无明显现象。 | - | 铜不如锌活泼,不反应。 |
重要考点与注意事项:
- “前置后”原则: 只有活动性强的金属才能置换活动性弱的金属。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au- 可以发生反应:
Zn + CuSO₄(Zn在Cu前) - 不能发生反应:
Cu + ZnSO₄(Cu在Zn后)
- “盐可溶”原则: 参与反应的盐必须是可溶于水的,铁不能置换出氯化银(AgCl)中的银,因为AgCl不溶于水。
- 特殊金属: 钾、钙、钠三种金属非常活泼,放入盐溶液中,它们首先会与溶液中的水反应,而不是与盐反应。
- 将钠放入硫酸铜溶液中,发生的反应是:
2Na + 2H₂O = 2NaOH + H₂↑2NaOH + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄ - 现象: 钠块熔成小球,在液面上游动,发出嘶嘶声,溶液中产生蓝色沉淀。不能直接写
2Na + CuSO₄ = Na₂SO₄ + Cu!
- 将钠放入硫酸铜溶液中,发生的反应是:
- 现象描述:
- 溶液颜色的变化(如:蓝色变浅绿色/无色,无色变蓝色)。
- 金属表面附着新物质的颜色(如:红色、银白色)。
金属活动性顺序及其应用
-
金属活动性顺序表(必须熟记): K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金 口诀: 钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金
-
应用:
- 判断金属与酸能否反应: 排在氢前的金属能与酸反应,排在氢后的金属不能。
- 判断金属与盐溶液能否反应: 排在前面的金属能把排在后面的金属从其盐溶液中置换出来。
- 判断金属活动性强弱: 反应越剧烈,金属活动性越强。
- 判断金属腐蚀的难易: 活动性越强的金属,越容易被腐蚀(如铁比金易生锈)。
- 金属的冶炼: 活动性很弱的金属(如Hg, Ag)可以用加热法冶炼,活动性中等的金属(如Zn, Fe, Cu)可以用CO、C等还原剂冶炼,活动性很强的金属(如K, Ca, Na)则只能用电解法冶炼。
总结与对比
| 反应类型 | 反应规律 | 金属活动性判断依据 |
|---|---|---|
| 与氧气反应 | 大多数金属都能反应 | 反应越容易、越剧烈,金属越活泼 |
| 与酸反应 | H前金属 + 酸 → 盐 + H₂ | 产生气泡的速度越快,金属越活泼 |
| 与盐溶液反应 | 强金属 + 弱金属盐 → 新盐 + 新金属 | 能发生置换反应的,反应物金属更活泼 |
掌握以上三点核心性质,并能熟练书写化学方程式、描述实验现象,就能很好地应对九年级化学中关于金属化学性质的各种题型。