分子原子如何构成物质?
校园之窗 2025年12月12日 15:46:21 99ANYc3cd6
九年级化学入门必看!彻底搞懂“分子”与“原子”,一篇文章就够了!
Meta描述: 九年级上册化学重点:分子和原子概念辨析、性质、关系图解,本文用最通俗的语言和生动比喻,帮你轻松攻克化学第一道难关,夯实中考基础,附典型例题解析。
(引言 - 抓住用户痛点,引发共鸣)

嗨,同学们,当你们翻开九年级化学课本,是不是被“分子”、“原子”这些看不见、摸不着的概念搞得一头雾水?感觉它们长得像,但又说不清道不明,别担心,你不是一个人!
“分子”和“原子”是整个化学世界的基石,是打开微观世界大门的两把钥匙,学好了它们,你后续的化学学习将会事半功倍,我就化身为你的专属化学导师,用最接地气的方式,带你彻底搞懂这两个“小家伙”,让你从此爱上化学!
第一部分:什么是分子?—— 物质构成的“小积木”
想象一下,你面前有一杯水,一块铁,一瓶氧气,这些宏观的物质,是由什么构成的呢?答案就是——分子。
分子的定义: 分子是保持物质化学性质的最小粒子。
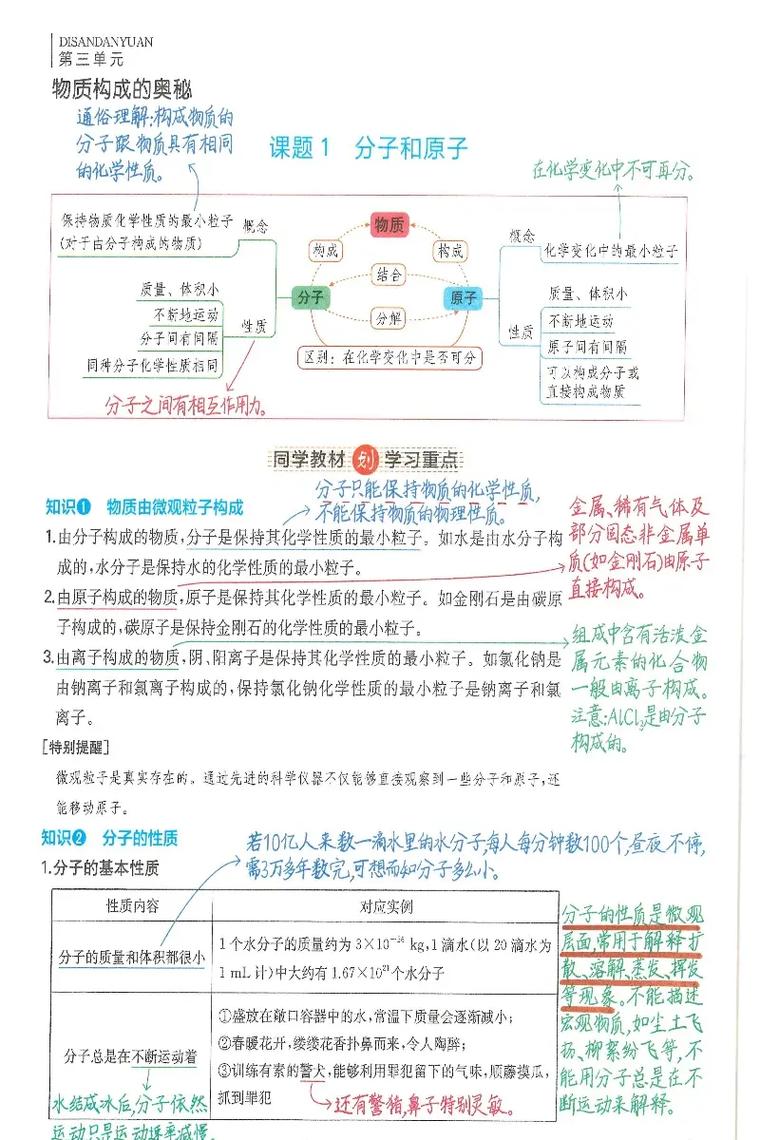
- “最小粒子”:什么意思?就是说,只要你还把它叫做“水”,那么它就至少得是一个水分子(H₂O),如果你把它再分,变成氢原子和氧原子,那它就不再是水了,失去了水的化学性质。
- “化学性质”:物理性质(如颜色、状态)是宏观的,由大量分子聚集后体现,但化学性质,比如水能灭火、能电解,是由单个水分子决定的。
分子的基本性质(重点!考点!):
-
① 质量很小,体积很小: 一滴水(约0.05mL)里大约有1.67 x 10²¹个水分子!如果把水分子想象成一枚硬币,那么一滴水就相当于地球那么大!是不是超乎想象?
-
② 分子之间有间隔: 这是最重要的一个性质!物质的三态变化(固、液、气)根本原因就是分子间隔不同。
- 固态:分子间隔最小,排列紧密,所以有固定形状。
- 液态:分子间隔较大,可以流动,所以没有固定形状。
- 气态:分子间隔最大,自由运动,所以既没有固定形状也没有固定体积。
- 生活实例:50毫升酒精和50毫升水混合,总体积小于100毫升,就是因为分子之间有间隔,彼此“挤”进去了。
-
③ 分子在不停地做无规则运动: 温度越高,分子运动越剧烈。
 (图片来源网络,侵删)
(图片来源网络,侵删)- 生活实例:路过面包店闻到香味、湿衣服晾干、糖放入水中整杯水都变甜,都是分子运动的结果。
-
④ 同种化学性质的分子,性质相同;不同种化学性质的分子,性质不同。
一个氧分子(O₂)和另一个氧分子的化学性质完全相同,但一个氧分子(O₂)和一个臭氧分子(O₃)的化学性质就不同。
第二部分:什么是原子?—— 分子拆分后的“最小零件”
现在我们知道了物质由分子构成,分子还能再分吗?能!在化学变化中,分子会“分家”。
原子的定义: 原子是化学变化中的最小粒子。
- “化学变化中的最小粒子”:这是原子和分子的核心区别!在化学变化(如燃烧、生锈、食物腐败)中,分子会破裂,分成更小的粒子——原子,但原子本身不能再分,它只是重新组合,形成新的分子。
- 举例说明:水电解生成氢气和氧气。
- 变化前:水分子(H₂O)
- 变化中:水分子破裂,变成氢原子和氧原子。
- 变化后:每2个氢原子重新组合成1个氢分子(H₂),每2个氧原子重新组合成1个氧气分子(O₂)。
- 关键点:在整个过程中,氢原子和氧原子本身没有改变,没有变成其他原子,它们只是“搬家”并“重新组队”了。
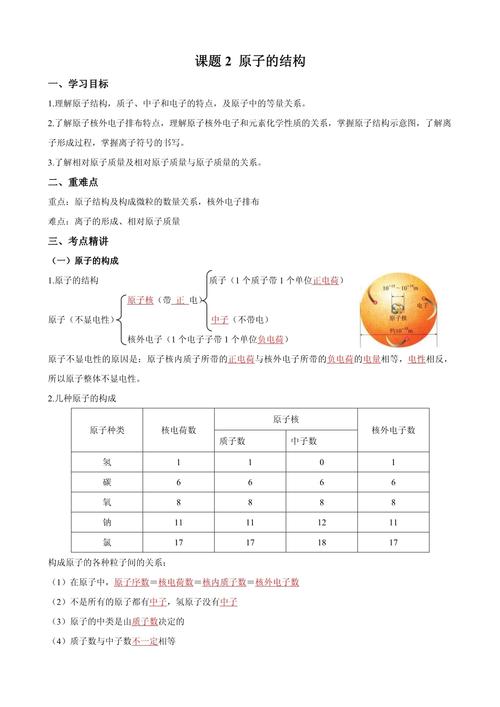
原子的构成:
原子虽然很小,但它并不是一个实心小球,它也有自己的“内部结构”,它由原子核和核外电子构成。
- 原子核:位于原子中心,带正电荷,体积很小,但几乎集中了原子的全部质量。
- 核外电子:在原子核外高速运动,带负电荷,质量极小,可以忽略不计。
- 原子核的构成:原子核又由质子(带正电)和中子(不带电)构成。
一个简单的比喻: 如果把一个原子放大到一座体育场那么大,那么原子核就像放在体育场中央的一颗小小的玻璃珠,而核外电子就像在观众席上快速飞舞的几只蜜蜂,是不是瞬间感觉原子内部“空空如也”?
核电荷数 = 质子数 = 核外电子数 在原子中,由于原子核带正电,核外电子带负电,而整个原子不显电性,所以它们的数量是相等的,这个数量(质子数)决定了这是什么元素的原子,我们称之为原子序数。
第三部分:分子与原子的关系与区别(一张图看懂!)
这是考试的绝对重点!请务必牢记。
| 对比项 | 分子 | 原子 |
|---|---|---|
| 定义 | 保持物质化学性质的最小粒子 | 化学变化中的最小粒子 |
| 在化学变化中 | 可以再分,破裂成原子 | 不可再分,只是重新组合 |
| 构成 | 由原子构成 | 由原子核(质子、中子)和核外电子构成 |
| 联系 | 分子是由原子构成的,分子是构成物质的一种微粒,原子是构成分子(或直接构成物质)的一种微粒。 |
总结一句话:分子是“大家族”,原子是“家庭成员”,在化学变化这个“分家”的过程中,家族(分子)会解散,但家庭成员(原子)不会消失,只会重新组成新的家族。
第四部分:微观世界大闯关——典型例题解析
【例题1】(判断题)
- A. 分子是保持物质性质的最小粒子。( )
- B. 原子是最小的粒子,不可再分。( )
【解析】
- A. 错误,分子保持的是物质的化学性质,而不是所有性质(如物理性质)。
- B. 错误,原子是化学变化中的最小粒子,在物理变化或核变化中,原子还可以再分(分为质子、中子、电子等)。
【例题2】(选择题) 下列关于分子和原子的说法正确的是( ) A. 物质都是由分子构成的 B. 化学变化中,分子本身不变,只是间隔改变 C. 分子是保持物质化学性质的唯一粒子 D. 在化学变化中,分子可以再分,原子不能再分
【解析】
- A. 错误,有些物质由分子构成(如H₂O),有些物质由原子直接构成(如Fe、He),有些由离子构成(如NaCl)。
- B. 错误,化学变化中,分子本身破裂,变成了原子,不是间隔改变(间隔改变是物理变化)。
- C. 错误,对于由原子直接构成的物质(如铁),保持其化学性质的最小粒子是铁原子本身,所以分子不是唯一的。
- D. 正确,这准确地描述了分子和原子在化学变化中的根本区别。
(- 总结升华,引导互动)
好了,同学们,关于九年级上册化学的“分子”和“原子”核心知识点,我们就讲到这里,希望大家通过这篇文章,能真正建立起微观世界的模型,理解这两个概念的精髓。
化学是一门研究“变”与“不变”的科学,在化学变化中,分子变了,但原子不变,抓住这个核心,很多难题就迎刃而解了。
学习是一个不断探索的过程,如果你还有任何疑问,或者有什么独到的理解,欢迎在评论区留言讨论!也别忘了点赞收藏,随时回来复习哦!你的每一个进步,都值得被鼓励!