九年级化学上册复习重点有哪些?
校园之窗 2025年12月17日 19:23:55 99ANYc3cd6
九年级上册化学核心复习提纲
第一单元 走进化学世界
化学是什么?
- 定义:化学是研究物质的组成、结构、性质及变化规律的科学。
- 核心特点:以实验为基础。
物质的变化与性质

(图片来源网络,侵删)
- 物理变化:没有生成其他物质的变化。
- 特征:状态、形状、大小的改变(如:水结冰、石蜡熔化、汽油挥发)。
- 判断依据:分子本身没有改变。
- 化学变化:生成了其他物质的变化(也叫化学反应)。
- 特征:发光、放热、产生气体、生成沉淀等。
- 判断依据:分子本身发生了改变,变成了新分子。
- 注意:化学变化中一定伴随物理变化,但物理变化中不一定发生化学变化。
- 物理性质:物质不需要发生化学变化就表现出来的性质。
- 举例:颜色、状态、气味、密度、熔点、沸点、硬度、溶解性、挥发性等。
- 化学性质:物质在化学变化中表现出来的性质。
- 举例:可燃性、助燃性、氧化性、还原性、酸性、碱性、稳定性等。
化学实验基本操作
- 药品的取用:
- 原则:“三不”原则——不闻、不尝、不摸。
- 固体药品:块状用镊子(“一横二放三慢竖”);粉末状用药匙或纸槽(“一斜二送三直立”)。
- 液体药品:少量用胶头滴管;较多量用倾倒法(标签向手心);定量用量筒。
- 物质的加热:
- 酒精灯:“两禁一顶”——禁止向燃着的酒精灯添加酒精,禁止用燃着的酒精灯点燃另一盏酒精灯,禁止用嘴吹灭(用灯帽盖灭)。
- 加热方法:
- 给液体加热:用试管、烧杯、蒸发皿,试管内液体体积不超过容积的1/3,试管口不能对着人。
- 给固体加热:用干燥的试管、坩埚等。
- 仪器的洗涤:
- 标准:内壁附着的水既不聚成水滴,也不成股流下,表示已洗干净。
- 洗涤方法:刷洗、冲洗、必要时用化学方法(如稀盐酸洗碳酸钙)。
第二单元 我们周围的空气
空气的组成
- 体积分数:
- 氮气(N₂):78%
- 氧气(O₂):21%
- 稀有气体:94% (He, Ne, Ar, Kr, Xe等)
- 二氧化碳(CO₂):03%
- 其他气体和杂质:03%
- 空气中氧气含量的测定实验:
- 原理:利用红磷燃烧消耗密闭容器内的氧气,生成固体五氧化二磷,容器内压强减小,水倒吸入容器,倒吸入水的体积约等于氧气的体积。
- 现象:红磷燃烧,产生大量白烟;冷却后,打开止水夹,水倒流入集气瓶,约占集气瓶容积的1/5。
- 氧气约占空气体积的1/5。
- 成功关键:
- 装置气密性良好。
- 红磷要过量(保证将氧气耗尽)。
- 冷却至室温后再打开止水夹(防止内部热胀冷缩影响结果)。
混合物与纯净物
- 混合物:由两种或多种物质混合而成(如:空气、海水、溶液)。
- 纯净物:由一种物质组成(如:氧气O₂、氮气N₂)。
氧气(O₂)的性质与用途

(图片来源网络,侵删)
- 物理性质:通常情况下,是无色、无味的气体,密度比空气略大,不易溶于水。
- 化学性质(比较活泼):
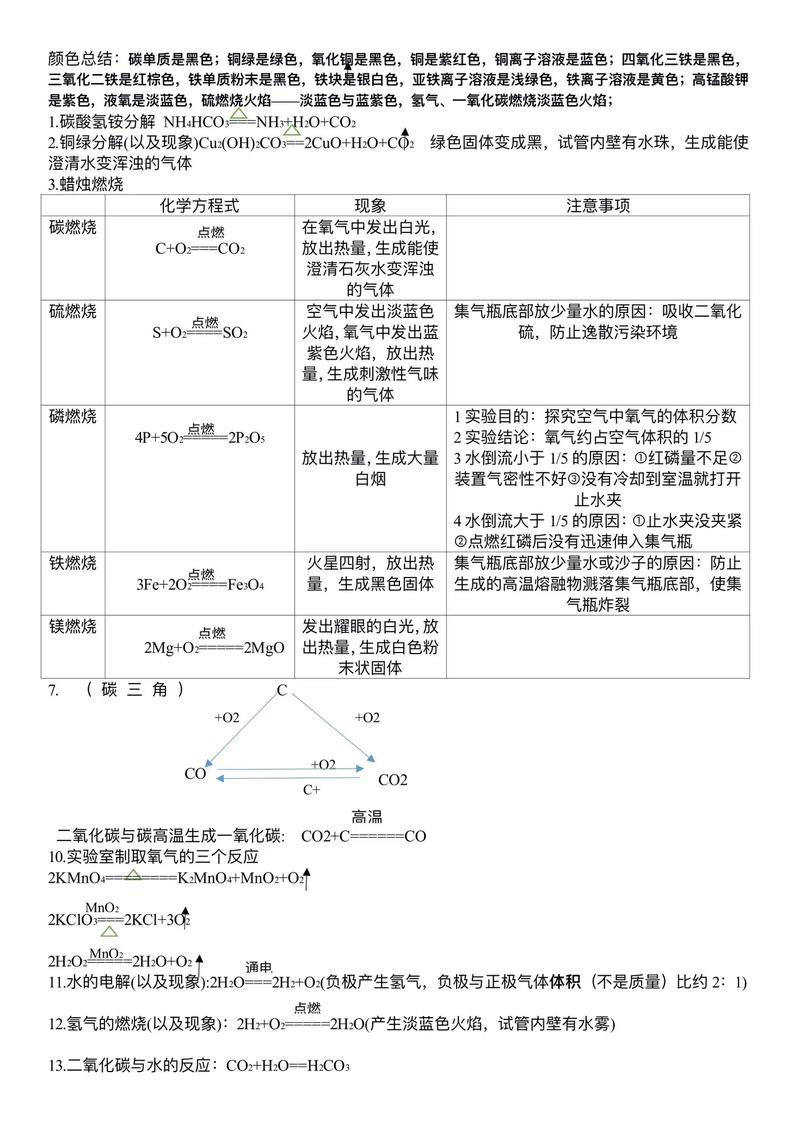
- 与碳反应:C + O₂ $\xrightarrow{点燃}$ CO₂ (发出白光,放出热量,使澄清石灰水变浑浊)
- 与硫反应:S + O₂ $\xrightarrow{点燃}$ SO₂ (明亮的蓝紫色火焰,生成有刺激性气味的气体)
- 与磷反应:4P + 5O₂ $\xrightarrow{点燃}$ 2P₂O₅ (产生大量白烟)
- 与铁反应:3Fe + 2O₂ $\xrightarrow{点燃}$ Fe₃O₄ (剧烈燃烧,火星四射,生成黑色固体)
- 与镁反应:2Mg + O₂ $\xrightarrow{点燃}$ 2MgO (耀眼白光,生成白色固体)
- 用途:供给呼吸(如潜水、医疗)、支持燃烧(如炼钢、气焊)。
氧气的制取
- 工业制法:分离液态空气法(物理变化,利用液氮和液氧的沸点不同)。
- 实验室制法:
- 药品:过氧化氢(H₂O₂)和二氧化锰(MnO₂) 或 高锰酸钾(KMnO₄) 或 氯酸钾(KClO₃)和二氧化锰(MnO₂)。
- 反应原理:
- 2H₂O₂ $\xrightarrow{MnO₂}$ 2H₂O + O₂↑ (固液常温型)
- 2KMnO₄ $\xrightarrow{\Delta}$ K₂MnO₄ + MnO₂ + O₂↑ (固固加热型)
- 2KClO₃ $\xrightarrow{MnO₂, \Delta}$ 2KCl + 3O₂↑ (固固加热型)
- 发生装置:
- 固液常温型:锥形瓶/试管 + 分液漏斗/长颈漏斗
- 固固加热型:试管 + 酒精灯
- 收集装置:
- 排水法:因为氧气不易溶于水。
- 向上排空气法:因为氧气密度比空气大。
- 验满:
- 排水法:当集气瓶口有大气泡冒出时,已收集满。
- 向上排空气法:将带火星的木条放在集气瓶口,木条复燃,已收集满。
- 检验:将带火星的木条伸入集气瓶中,木条复燃,证明是氧气。
催化剂与催化作用
- 定义:在化学反应里,能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有改变的物质。
- 特点:“一变两不变”——改变速率、质量不变、化学性质不变。
第三单元 物质构成的奥秘
分子与原子
- 分子:保持物质化学性质的最小粒子。
特征:质量、体积小;不断运动;分子间有间隔。
 (图片来源网络,侵删)
(图片来源网络,侵删) - 原子:化学变化中的最小粒子。
- 在化学变化中,分子可以再分,而原子不能再分。
- 关系:分子由原子构成,原子可以构成分子,也可以直接构成物质。
原子的构成
- 原子 $\begin{cases} \text{原子核} \begin{cases} \text{质子 (带正电)} \ \text{中子 (不带电)} \end{cases} \ \text{核外电子 (带负电)} \end{cases}$
- 电性关系:核电荷数 = 质子数 = 核外电子数(原子中)。
- 质量关系:原子的质量主要集中在原子核上。
元素
- 定义:具有相同核电荷数(即质子数)的一类原子的总称。
- 地壳中元素含量排名:氧、硅、铝、铁 (O, Si, Al, Fe)。
- 元素符号:
- 书写:“一大二小”(如:Na, Ca, Hg)。
- 意义:①表示一种元素;②表示该元素的一个原子。
- 元素周期表:
- 周期:横行,共有7个周期。
- 族:纵行,共有18个族。
- 原子序数 = 质子数。
离子
- 定义:带电荷的原子或原子团。
- 形成:原子得电子带负电,形成阴离子(如Cl⁻);原子失电子带正电,形成阳离子(如Na⁺)。
- 物质构成:
- 由原子直接构成的物质:金属、稀有气体、部分非金属固体(如C, Si)。
- 由分子构成的物质:气态非金属单质(如O₂, N₂)、化合物(如H₂O, CO₂)。
- 由离子构成的物质:绝大多数盐、碱(如NaCl, Ca(OH)₂)。
化学式与化合价
- 化学式:用元素符号和数字的组合表示物质组成的式子。
- 意义:①表示一种物质;②表示该物质的元素组成;③表示该物质的一个分子;④表示一个分子的构成。
- 书写:单质、化合物(正价在前,负价在后,化合价代数和为零)。
- 化合价:
- 规则:化合物中,正负化合价代数和为零。
- 常见元素化合价口诀:
一价氢氯钾钠银,二价氧钙钡镁锌, 三铝四硅五价磷,二三铁,二四碳, 二四六硫都齐全,铜汞二价最常见。
- 应用:根据化学式求某元素化合价;根据化合价书写化学式。
有关化学式的计算
- 相对分子质量:化学式中各原子的相对原子质量的总和。
- 各元素质量比:各元素的相对原子质量 × 原子个数之比。
- 某元素的质量分数 = (该元素的相对原子质量 × 原子个数 / 相对分子质量) × 100%。
第四单元 自然界的水
水的净化
- 天然水:混合物(含有泥沙、可溶性杂质、细菌等)。
- 净化方法:
- 沉降:静置、加明矾吸附。
- 过滤:除去不溶性固体杂质。
- 吸附:用活性吸附色素和异味。
- 蒸馏:得到纯净物(液态水),净化程度最高。
- 硬水与软水:
- 硬水:含有较多可溶性钙、镁化合物的水。
- 软水:不含或含较少可溶性钙、镁化合物的水。
- 鉴别:用肥皂水,产生泡沫多的是软水,泡沫少、浮渣多的是硬水。
- 硬水软化:煮沸、蒸馏。
水的组成
- 电解水实验:
- 现象:正极产生气体少,负极产生气体多,体积比约为 1:2。
- 检验:正极气体能使带火星木条复燃(是氧气O₂);负极气体能燃烧,有淡蓝色火焰(是氢气H₂)。
- 水是由氢元素和氧元素组成的;在化学变化中,分子可以再分,原子不能再分。
- 化学方程式:2H₂O $\xrightarrow{通电}$ 2H₂↑ + O₂↑
单质与化合物
- 单质:由同种元素组成的纯净物(如:O₂, H₂, Fe)。
- 化合物:由不同种元素组成的纯净物(如:H₂O, CO₂, KClO₃)。
- 氧化物:由两种元素组成,其中一种是氧元素的化合物(如:H₂O, CO₂, Fe₂O₃)。
第五单元 化学方程式
质量守恒定律
- 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
- 微观解释:化学反应前后,原子的种类、数目、质量均不改变。
- “五个不变,两个一定改变,一个可能改变”:
- 不变:原子种类、原子数目、原子质量、元素种类、物质总质量。
- 一定改变:分子种类、物质种类。
- 可能改变:分子数目。
化学方程式
- 定义:用化学式表示化学反应的式子。
- 意义:
- 质:表示什么物质参加了反应,生成了什么物质。
- 量:表示各物质之间的质量比。
- 量:表示各反应物和生成物之间的粒子数目之比。
- 书写步骤:
- 写:正确写出反应物和生成物的化学式。
- 配:配平化学方程式(最小公倍数法、观察法等)。
- 注:注明反应条件(点燃、加热Δ、催化剂等)和生成物状态(↑、↓)。
- 等:将短线改为“”。
- 配平原则:左、右两边各原子的数目相等。
第六单元 碳和碳的氧化物
碳的单质
- 金刚石:自然界最硬的物质,用于切割、钻头。
- 石墨:质软、有滑腻感、有良好导电性,用于电极、铅笔芯。
- C₆₀:足球烯,由分子构成。
- 化学性质:
- 常温下:化学性质稳定。
- 可燃性:
- 充分燃烧(氧气充足):C + O₂ $\xrightarrow{点燃}$ CO₂
- 不充分燃烧(氧气不足):2C + O₂ $\xrightarrow{点燃}$ 2CO
- 还原性:与金属氧化物反应,如:C + 2CuO $\xrightarrow{高温}$ 2Cu + CO₂↑ (黑色粉末变红色)
二氧化碳(CO₂)
- 实验室制法:
- 药品:大理石/石灰石(主要成分CaCO₃)和稀盐酸。
- 原理:CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑
- 装置:固液常温型(与制O₂相同)。
- 收集:向上排空气法(因为CO₂密度比空气大,且能溶于水)。
- 验满:将燃着的木条放在集气瓶口,木条熄灭,已收集满。
- 检验:将气体通入澄清石灰水,若变浑浊,证明是CO₂。
- 物理性质:无色、无味的气体,密度比空气大,能溶于水,固态叫“干冰”(易升华吸热)。
- 化学性质:
- 不能燃烧,不支持燃烧(不供给呼吸)。
- 与水反应:CO₂ + H₂O = H₂CO₃ (碳酸),碳酸不稳定,易分解:H₂CO₃ = H₂O + CO₂↑
- 与石灰水反应:CO₂ + Ca(OH)₂ = CaCO₃↓ + H₂O (此反应用于检验CO₂)。
- 用途:灭火、作制冷剂(干冰)、人工降雨、化工原料。
一氧化碳(CO)
- 物理性质:无色、无味的气体,密度与空气相近,难溶于水。
- 化学性质:
- 可燃性:2CO + O₂ $\xrightarrow{点燃}$ 2CO₂ (蓝色火焰)
- 毒性:与血液中的血红蛋白结合,使人缺氧。
- 还原性:CO + CuO $\xrightarrow{\Delta}$ Cu + CO₂ (黑色粉末变红色)
第七单元 燃料及其利用
燃烧与灭火
- 燃烧条件(同时满足):
- 可燃物
- 与氧气(或空气)接触
- 温度达到着火点
- 灭火原理(破坏任意一个条件即可):
- 清除可燃物或使可燃物与其他物品隔离
- 隔绝氧气(或空气)
- 使温度降到着火点以下
化石燃料
- 三大化石燃料:煤、石油、天然气(都是混合物)。
- 天然气:主要成分是甲烷(CH₄)。
- 物理性质:无色、无味,密度比空气小,极难溶于水。
- 化学性质:具有可燃性,燃烧时产生明亮的蓝色火焰。
- 化学方程式:CH₄ + 2O₂ $\xrightarrow{点燃}$ CO₂ + 2H₂O
能源与环境
- 清洁能源:氢能、太阳能、风能、地热能等。
- 使用化石燃料的负面影响:温室效应、酸雨、空气污染。
重要化学方程式汇总
| 反应物 | 生成物 | 反应条件 | 化学方程式 | 现象/应用 |
|---|---|---|---|---|
| 碳 + 氧气 | 二氧化碳 | 点燃 | C + O₂ $\xrightarrow{点燃}$ CO₂ | 发出白光,放热 |
| 碳 + 氧气 | 一氧化碳 | 点燃(不充分) | 2C + O₂ $\xrightarrow{点燃}$ 2CO | |
| 硫 + 氧气 | 二氧化硫 | 点燃 | S + O₂ $\xrightarrow{点燃}$ SO₂ | 明亮蓝紫色火焰,刺激性气味 |
| 磷 + 氧气 | 五氧化二磷 | 点燃 | 4P + 5O₂ $\xrightarrow{点燃}$ 2P₂O₅ | 产生大量白烟 |
| 铁 + 氧气 | 四氧化三铁 | 点燃 | 3Fe + 2O₂ $\xrightarrow{点燃}$ Fe₃O₄ | 剧烈燃烧,火星四射,生成黑色固体 |
| 镁 + 氧气 | 氧化镁 | 点燃 | 2Mg + O₂ $\xrightarrow{点燃}$ 2MgO | 耀眼白光,生成白色固体 |
| 氢气 + 氧气 | 水 | 点燃 | 2H₂ + O₂ $\xrightarrow{点燃}$ 2H₂O | 安静燃烧,淡蓝色火焰 |
| 过氧化氢 | 水 + 氧气 | 二氧化锰 | 2H₂O₂ $\xrightarrow{MnO₂}$ 2H₂O + O₂↑ | |
| 高锰酸钾 | 锰酸钾 + 二氧化锰 + 氧气 | 加热 | 2KMnO₄ $\xrightarrow{\Delta}$ K₂MnO₄ + MnO₂ + O₂↑ | |
| 氯酸钾 | 氯化钾 + 氧气 | 二氧化锰、加热 | 2KClO₃ $\xrightarrow{MnO₂, \Delta}$ 2KCl + 3O₂↑ | |
| 水 | 氢气 + 氧气 | 通电 | 2H₂O $\xrightarrow{通电}$ 2H₂↑ + O₂↑ | 正负极气体体积比1:2 |
| 碳 + 氧化铜 | 铜 + 二氧化碳 | 高温 | C + 2CuO $\xrightarrow{高温}$ 2Cu + CO₂↑ | 黑色变红色,生成气体使石灰水变浑浊 |
| 石灰石 + 盐酸 | 氯化钙 + 水 + 二氧化碳 | 常温 | CaCO₃ + 2HCl = CaCl₂ + H₂O + CO₂↑ | 实验室制CO₂ |
| 二氧化碳 + 水 | 碳酸 | CO₂ + H₂O = H₂CO₃ | ||
| 碳酸 | 水 + 二氧化碳 | H₂CO₃ = H₂O + CO₂↑ | ||
| 二氧化碳 + 氢氧化钙 | 碳酸钙 + 水 | CO₂ + Ca(OH)₂ = CaCO₃↓ + H₂O | 检验CO₂ | |
| 甲烷 + 氧气 | 二氧化碳 + 水 | 点燃 | CH₄ + 2O₂ $\xrightarrow{点燃}$ CO₂ + 2H₂O | 明亮蓝色火焰 |
| 一氧化碳 + 氧气 | 二氧化碳 | 点燃 | 2CO + O₂ $\xrightarrow{点燃}$ 2CO₂ | 蓝色火焰 |
| 一氧化碳 + 氧化铜 | 铜 + 二氧化碳 | 加热 | CO + CuO $\xrightarrow{\Delta}$ Cu + CO₂ | 黑色变红色 |
复习建议
- 回归课本:所有知识点都源于课本,务必仔细阅读课本,理解基本概念。
- 构建框架:利用思维导图等方式,将各个单元的知识点串联起来,形成知识网络。
- 重视实验:化学是以实验为基础的学科,复习时,要弄清每个实验的目的、原理、步骤、现象和结论。
- 勤练化学方程式:不仅要会写,还要理解其反应原理和应用场景,做到“见式知意”。
- 整理错题:建立错题本,分析错误原因,避免重复犯错。
- 模拟测试:在复习后期,找一些高质量的模拟题进行限时训练,查漏补缺,熟悉考试节奏。
祝你复习顺利,取得优异成绩!