九年级上册化学单元小结有哪些重点考点?
校园之窗 2025年12月16日 09:11:04 99ANYc3cd6
九年级上册化学单元总览
九年级上册化学主要带领我们走进奇妙的微观世界,认识我们身边无处不在的化学物质,并初步学习研究化学的基本方法,全册内容可以大致分为以下几个核心单元:
- 第一、二单元:化学入门与基本概念
- 认识化学,了解化学研究的对象和作用。
- 掌握化学实验的基本操作,这是化学的“基本功”。
- 认识我们身边的物质:空气、氧气,理解物质的性质和变化。
- 第三、四单元:构成物质的基本微粒
- 深入微观世界,探索分子、原子、离子的奥秘。
- 学习元素、化学式等化学“语言”,为后续学习打下坚实基础。
- 第五单元:化学变化的定量研究
- 认识质量守恒定律,这是化学变化的基本规律。
- 学习化学方程式,用符号语言来表示和定量研究化学反应。
- 第六单元:碳和碳的氧化物
- 认识碳家族的重要成员:金刚石、石墨、C60。
- 学习两种重要的碳的氧化物:二氧化碳和一氧化碳,了解它们的性质和用途。
- 第七、八单元:燃料及其利用
- 认识燃烧的条件,了解灭火的原理。
- 学习三大化石燃料:煤、石油、天然气。
- 认识清洁能源,树立能源和环境意识。
各单元核心知识点与小结
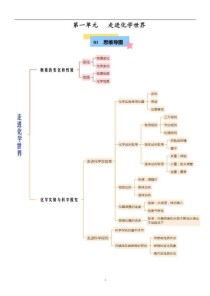
第一、二单元:走进化学世界 & 我们周围的空气
核心主题: 认识化学,掌握基本操作,认识空气和氧气。
(图片来源网络,侵删)
核心知识点
- 化学研究的对象: 物质的组成、结构、性质以及变化规律。
- 化学变化与物理变化的根本区别: 是否有新物质生成。
- 化学变化:如燃烧、生锈、食物腐败。
- 物理变化:如水结冰、汽油挥发、灯泡发光。
- 化学性质与物理性质:
- 化学性质:在化学变化中表现出来的性质(如可燃性、助燃性、酸性、碱性)。
- 物理性质:不需要通过化学变化就能表现出来的性质(如颜色、状态、气味、密度、熔点、沸点、溶解性、硬度)。
- 化学实验基本操作(重中之重):
- 药品取用:“三不”原则(不闻、不尝、不摸);固体药品的取用(块状用镊子,粉末用药匙);液体药品的取用(倾倒、滴加)。
- 加热: 酒精灯的使用(“三禁止”);给物质加热(先预热,后集中加热;外壁干燥,液体不超过容积1/3)。
- 仪器洗涤: 洗净的标准是内壁附着的水既不聚成水滴,也不成股流下。
- 空气的组成:
- 按体积计算,大约是:氮气 (N₂) 78%,氧气 (O₂) 21%,稀有气体 0.94%,二氧化碳 0.03%,其他气体和杂质 0.03%。
- 氧气:供给呼吸、支持燃烧,具有助燃性和氧化性。
- 氮气:化学性质不活泼,常用作保护气(如食品包装灯泡填充气)。
- 稀有气体:化学性质稳定,常用作保护气,通电时发出不同颜色的光(用于霓虹灯、电光源)。
重点与难点
- 重点: 化学变化的判断;常见仪器的识别和使用;氧气的化学性质(特别是与碳、硫、铁、磷的反应现象)。
- 难点: 对“性质”和“变化”的准确理解和区分;实验操作的规范性和安全性意识。
学习方法
- 动手实践: 亲手做实验,比看书本印象更深刻,牢记每一步操作的目的和注意事项。
- 对比记忆: 将物理变化和化学变化、物理性质和化学性质放在一起对比记忆。
- 口诀记忆: 如酒精灯的使用:“灯帽两下盖,酒精三分满,点燃用外焰,熄灯帽盖回。”
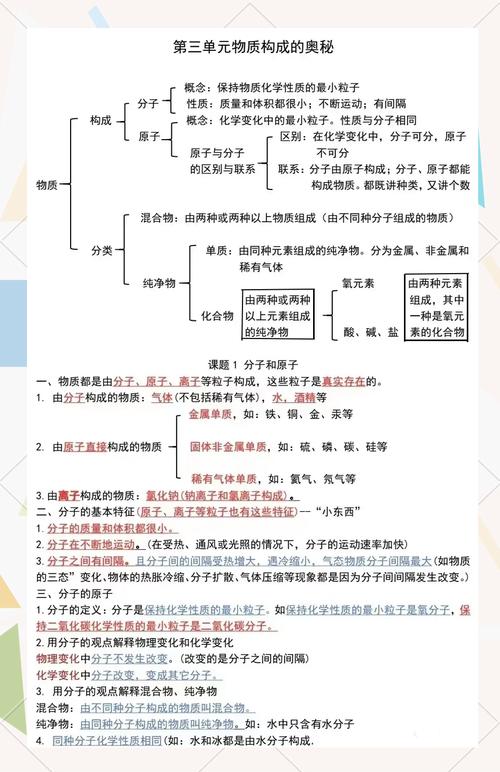
第三、四单元:物质构成的奥秘
核心主题: 探索微观世界,学习化学用语。
(图片来源网络,侵删)
核心知识点
- 分子:
- 定义: 保持物质化学性质的最小粒子。
- 特性: 质量小、体积小;不断运动;分子间有间隔。
- 应用: 解释“热胀冷缩”、“三态变化”、“闻到花香”等宏观现象。
- 原子:
- 定义: 化学变化中的最小粒子。
- 结构: 由居于中心的原子核(质子、中子)和核外的电子构成。
- 关系: 核电荷数 = 质子数 = 核外电子数(原子中)。
- 离子:
- 定义: 带电荷的原子或原子团。
- 形成: 原子得电子形成阴离子(带负电),失电子形成阳离子(带正电)。
- 元素:
- 定义: 质子数(即核电荷数)相同的一类原子的总称。
- 分类: 金属元素、非金属元素、稀有气体元素。
- 元素符号: 国际统一,表示一种元素和一个该元素的原子。
- 化学式与化合价:
- 化学式: 用元素符号和数字的组合表示物质组成的式子。
- 意义: (宏观)表示一种物质;表示该物质的元素组成。(微观)表示一个该分子;表示分子的构成。
- 化合价: 元素在形成化合物时表现出的一种性质。化合物中正负化合价代数和为零。
- 书写化学式: “排序标价,交叉化简,检验正负”。
重点与难点
- 重点: 分子、原子、离子的区别与联系;元素的概念;化学式的书写与意义;化合价的应用。
- 难点: 建立微观粒子与宏观物质之间的联系;理解原子结构;化合价的应用(特别是根据化合价书写化学式)。
学习方法
- 模型构建: 利用原子结构示意图、分子模型等,将抽象的微观粒子形象化。
- 归纳总结: 制作表格,对比分子、原子、离子的异同点。
- 口诀记忆: 如常见元素化合价口诀:“钾钠银氢正一价,钙镁钡锌正二价……”
- 多练多写: 化学式的书写没有捷径,只有通过反复练习才能熟练掌握。
第五单元:化学方程式
核心主题: 质量守恒定律与化学方程式。

(图片来源网络,侵删)
核心知识点
- 质量守恒定律:
- 参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
- 微观解释: 化学反应前后,原子的种类、数目、质量均不改变。
- 化学方程式:
- 定义: 用化学式表示化学反应的式子。
- 意义:
- 质: 表示什么物质参加了反应,生成了什么物质。
- 量: 表示反应物和生成物各物质之间的质量比。
- 量: 表示反应物和生成物各物质间的粒子(分子、原子)数目比。
- 书写原则: 客观事实为基础;质量守恒(配平)为准则。
- 书写步骤: 写(正确写出反应物和生成物的化学式)→ 配(配平化学方程式)→ 标(标明反应条件、生成物状态“↑”“↓”)→ 查(检查)。
重点与难点
- 重点: 质量守恒定律的理解和应用;化学方程式的书写与配平。
- 难点: 从微观角度理解质量守恒的原因;化学方程式的配平方法(观察法、最小公倍数法、奇数配偶法等)。
学习方法
- 理解本质: 原子三不变”是理解质量守恒的核心。
- 掌握方法: 熟练掌握至少一种化学方程式配平方法,并多加练习。
- 联系实际: 将化学方程式与具体的实验现象联系起来,加深理解。
第六单元:碳和碳的氧化物
核心主题: 认识碳单质及其重要氧化物。
核心知识点
- 碳的单质:
- 金刚石: 最硬的天然物质,用于切割、钻头。
- 石墨: 质软、有滑感、能导电,用于铅笔芯、电极。
- C60: 分子足球结构,应用于材料科学、超导。
- 共同点: 都是由碳元素组成的单质,物理性质差异巨大,原因是碳原子的排列方式不同。
- 碳的化学性质:
- 常温下稳定(古代字画保存至今)。
- 可燃性: C + O₂(足量) $\xrightarrow{\text{点燃}}$ CO₂; 2C + O₂(不足量) $\xrightarrow{\text{点燃}}$ 2CO。
- 还原性: C + 2CuO $\xrightarrow{\text{高温}}$ 2Cu + CO₂↑ (冶炼金属)。
- 二氧化碳 (CO₂):
- 物理性质: 无色无味气体,密度比空气大,能溶于水,固态叫“干冰”,易升华吸热。
- 化学性质:
- 不能燃烧,不支持燃烧(不助燃)。
- 与水反应: CO₂ + H₂O = H₂CO₃ (碳酸),碳酸不稳定,易分解 H₂CO₃ = CO₂↑ + H₂O。
- 与碱反应: CO₂ + Ca(OH)₂ = CaCO₃↓ + H₂O (检验CO₂)。
- 用途: 光合作用、灭火、制冷剂、人工降雨、化工原料。
- 一氧化碳:
- 物理性质: 无色无味气体,密度比空气略小,难溶于水。
- 化学性质:
- 可燃性: 2CO + O₂ $\xrightarrow{\text{点燃}}$ 2CO₂ (蓝色火焰)。
- 毒性: 与血液中的血红蛋白结合,使人体缺氧。
- 还原性: 3CO + Fe₂O₃ $\xrightarrow{\text{高温}}$ 2Fe + 3CO₂ (炼铁)。
重点与难点
- 重点: 碳单质的性质和用途;二氧化碳的化学性质(特别是与水和石灰水的反应);CO和CO₂的性质比较。
- 难点: 理解物质结构决定性质;CO的还原性实验操作;CO₂和CO的鉴别。
学习方法
- 对比学习: 将金刚石和石墨、CO和CO₂放在一起对比,找出异同点,归纳原因。
- 实验探究: 关注CO₂的制备、收集、检验、除杂等实验,理解其性质的应用。
- 归纳总结: 总结CO₂的“三化”(物理变化:干冰升华;化学变化:与水反应、与碱反应;氧化反应:光合作用)。
第七、八单元:燃料及其利用
核心主题: 燃烧、能源与环境。
核心知识点
- 燃烧与灭火:
- 燃烧条件(缺一不可): ①可燃物;②氧气(或空气);③达到着火点。
- 灭火原理(破坏至少一个条件): ①清除可燃物;②隔绝氧气(或空气);③降温到着火点以下。
- 化石燃料:
- 煤: 主要含碳,还含氢、硫等元素,被称为“工业的粮食”。
- 石油: 主要含碳、氢元素,被称为“工业的血液”。
- 天然气: 主要成分是甲烷 (CH₄)。
- 甲烷性质: 无色无味气体,密度比空气小,极难溶于水,具有可燃性,燃烧产生明亮的蓝色火焰,生成CO₂和H₂O。
- 能源与环境:
- 使用化石燃料的缺点: 资源有限;燃烧产生污染物(如SO₂、NO₂,形成酸雨);产生大量CO₂,导致温室效应。
- 清洁能源: 乙醇、氢气、太阳能、风能、核能等。
- 燃料的充分燃烧: 燃烧时要有足够多的空气;燃料与空气要有足够大的接触面积。
重点与难点
- 重点: 燃烧的条件和灭火的原理;三大化石燃料的组成、性质和用途;使用化石燃料对环境的影响及对策。
- 难点: 运用燃烧原理解释生活中的燃烧和灭火现象;理解燃料不充分燃烧的危害。
学习方法
- 理论联系实际: 用燃烧和灭火的原理解释生活中现象,如森林灭火、油锅着火等。
- 关注社会热点: 了解能源危机、环境污染等议题,培养社会责任感。
- 构建知识网络: 将燃料、燃烧、能源、环境等知识点串联起来,形成完整的知识体系。
总结与建议
九年级上册化学是整个化学学科的基础,知识点多且零散,但内在逻辑性很强。
- 构建知识网络: 不要孤立地记忆知识点,要尝试将它们联系起来。“原子构成”是理解“元素周期表”的基础,“化学式”是书写“化学方程式”的基础,“质量守恒”是配平“化学方程式”的依据。
- 重视实验: 化学是一门以实验为基础的学科,通过实验,可以直观地理解物质的性质和变化规律,培养观察能力和动手能力。
- 勤于思考,多问为什么: 对于任何一个知识点,多问几个“为什么”,为什么化学变化有新物质生成?为什么CO₂能灭火而CO不能?这种探究式的学习方式会让你理解得更透彻。
- 规范化学用语: 元素符号、化学式、化学方程式是化学的“语言”,必须做到书写规范、含义清晰,这是学好化学的基本功。
希望这份小结能帮助你更好地复习和掌握九年级上册的化学知识!祝你学习进步!