九年级化学下册课本有哪些核心知识点?
校园之窗 2026年1月12日 09:19:55 99ANYc3cd6
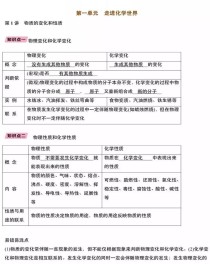
九年级化学(人教版)下册整体结构概览
九年级化学下册主要围绕酸、碱、盐这三大类物质展开,并延伸到化学与生活、化学基本计算和实验探究,其内容可以大致分为以下几个单元:
| 单元 | 核心主题 | 概览 |
|---|---|---|
| 第八单元 | 金属和金属材料 | 金属的物理性质、合金、金属的化学活动性顺序、金属的冶炼与保护、金属资源的利用。 |
| 第九单元 | 溶液 | 溶液的形成、溶解度、溶质的质量分数、配制一定溶质质量分数的溶液。 |
| 第十单元 | 酸和碱 | 常见的酸(盐酸、硫酸)和碱(氢氧化钠、氢氧化钙)的性质与用途、酸碱中和反应、溶液的酸碱度(pH)。 |
| 第十一单元 | 盐 化肥 | 常见的盐(氯化钠、碳酸钠、碳酸氢钠)的性质与用途、化学肥料、复分解反应及其发生的条件。 |
| 第十二单元 | 化学与生活 | 人类重要的营养物质(糖类、油脂、蛋白质、维生素、水、无机盐)、化学元素与人体健康、有机合成材料。 |
| 附录 | 部分酸、碱和盐的溶解性表、初中化学基本概念和原理总结、化学方程式等。 |
各单元核心知识点详解
第八单元 金属和金属材料
-
金属的物理性质:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 常见共性:有金属光泽、导电性、导热性、延展性。
- 差异性:颜色(铜紫红,金金黄,铁银白)、状态(汞是液态)、密度、硬度等不同。
-
合金:
- 定义:在金属中加热熔合某些金属或非金属而形成的具有金属特性的物质。
- 特点:合金的强度和硬度一般比它们的纯金属更高,抗腐蚀性能也更好。
- 常见合金:生铁、钢(铁的合金);黄铜(铜锌合金)、青铜(铜锡合金);硬铝等。
-
金属的化学性质:
- 与氧气反应:大多数金属能与氧气反应生成氧化物(如铁生锈、铜生锈)。
- 与酸反应:位于氢前面的金属能与稀盐酸、稀硫酸反应生成盐和氢气。(注意:硝酸、浓硫酸除外)
- 与盐溶液反应:活泼金属能把不活泼金属从它们的盐溶液中置换出来。(如:铁与硫酸铜溶液反应)
-
金属活动性顺序:
- 钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
- 应用:
- 判断金属与酸能否反应:排在前面的金属能与酸反应。
- 判断金属与盐溶液能否反应:排在前面的金属能把排在后面的金属从其盐溶液中置换出来。
- 判断金属活动性强弱。
-
金属资源的利用和保护:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 炼铁原理:在高温下,利用一氧化碳将铁从铁矿石里还原出来。(
3CO + Fe₂O₃ == 高温 == 2Fe + 3CO₂) - 铁的锈蚀:与氧气和水共同作用的结果。
- 防锈措施:隔绝氧气或水(如涂油、刷漆、电镀、制成不锈钢等)。
- 炼铁原理:在高温下,利用一氧化碳将铁从铁矿石里还原出来。(
第九单元 溶液
-
溶液的形成:
- 定义:一种或几种物质分散到另一种物质中,形成的均一、稳定的混合物。
- 组成:溶质(被溶解的物质)、溶剂(能溶解其他物质的物质),水是最常见的溶剂。
- 特征:均一性、稳定性。
-
溶解度:
- 饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能再继续溶解时,所得到的溶液。
- 定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
- 影响因素:
- 温度:大多数固体物质的溶解度随温度升高而增大(如硝酸钾);少数随温度升高而减小(如熟石灰)。
- 压强:主要影响气体,压强越大,气体溶解度越大。
-
溶质的质量分数:
- 定义:溶质质量与溶液质量之比。
- 公式:
溶质的质量分数 = (溶质的质量 / 溶液的质量) × 100% - 应用:计算、配制溶液、稀释溶液(稀释前后,溶质质量不变)。
第十单元 酸和碱
-
常见的酸:
 (图片来源网络,侵删)
(图片来源网络,侵删)- 盐酸:无色液体,有刺激性气味,有挥发性(瓶口有白雾)。
- 硫酸:无色粘稠油状液体,不挥发,有强烈的腐蚀性。
- 酸的通性(由H⁺离子决定):
- 使紫色石蕊试液变红,无色酚酞试液不变色。
- 与活泼金属反应生成盐和氢气。
- 与金属氧化物反应生成盐和水。
- 与碱发生中和反应生成盐和水。
- 与某些盐反应生成新酸和新盐。
-
常见的碱:
- 氢氧化钠:白色固体,易潮解,有强烈的腐蚀性(俗称烧碱、火碱、苛性钠)。
- 氢氧化钙:白色粉末,微溶于水,有腐蚀性(俗称熟石灰、消石灰)。
- 碱的通性(由OH⁻离子决定):
- 使紫色石蕊试液变蓝,无色酚酞试液变红。
- 与非金属氧化物反应生成盐和水。
- 与酸发生中和反应。
- 与某些盐反应生成新碱和新盐。
-
中和反应:
- 定义:酸与碱作用生成盐和水的反应。
- 应用:改良土壤酸性、处理工业废水、医药(如胃酸过多)等。
-
溶液的酸碱度——pH:
- 范围:0 ~ 14。
- 意义:
- pH < 7,溶液呈酸性,pH越小,酸性越强。
- pH = 7,溶液呈中性。
- pH > 7,溶液呈碱性,pH越大,碱性越强。
- 测定:用pH试纸(粗略测定)或pH计(精确测定)。
第十一单元 盐 化肥
-
常见的盐:
- 氯化钠:食盐,重要的调味品和防腐剂,医疗上生理盐水。
- 碳酸钠(Na₂CO₃):俗称纯碱、苏打,虽显碱性但不是碱。
- 碳酸氢钠(NaHCO₃):俗称小苏打,用于发酵、灭火剂等。
- 硫酸铜(CuSO₄):白色粉末,遇水变蓝(检验水),用于配制农药波尔多液。
-
化学肥料:
- 氮肥:促进茎叶生长茂盛(如尿素 NH₂COOH)。
- 磷肥:促进根系发达,增强抗寒抗旱能力(如磷矿粉 Ca₃(PO₄)₂)。
- 钾肥:促进茎秆粗壮,增强抗病虫害和倒伏能力(如硫酸钾 K₂SO₄)。
- 复合肥:含两种或两种以上营养元素(如硝酸钾 KNO₃)。
-
复分解反应:
- 定义:由两种化合物互相交换成分,生成另外两种化合物的反应。
- 发生的条件:生成物中有沉淀、气体或水三者之一。
第十二单元 化学与生活
-
人类重要的营养物质:
- 蛋白质:构成细胞的基本物质,如血红蛋白、酶。
- 糖类:主要供能物质,如葡萄糖、蔗糖、淀粉。
- 油脂:重要的备用能源。
- 维生素:调节新陈代谢,如维生素C(坏血病)、维生素A(夜盲症)。
-
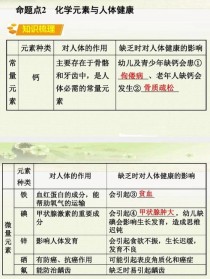
化学元素与人体健康:
- 常量元素:O, C, H, N, Ca, P, K, S, Na, Cl, Mg(占99.95%)。
- 微量元素:Fe(血红蛋白)、I(甲状腺激素)、Zn(生长发育)、Se(防癌)等,摄入过多或过少都有害。
-
有机合成材料:
- 有机物:含碳元素的化合物(CO, CO₂, 碳酸盐等除外)。
- 三大合成材料:塑料、合成纤维、合成橡胶。
- “白色污染”:指废弃塑料带来的环境问题,解决方法:减少使用、重复使用、使用可降解塑料、回收利用。
学习建议
- 构建知识网络前后联系紧密,金属活动性顺序用于判断置换反应,酸碱中和反应是复分解反应的一种,溶液知识贯穿始终,要善于将零散的知识点串联成网。
- 重视化学实验:化学是一门以实验为基础的学科,对于课本上的每一个实验,不仅要记住现象和结论,更要理解实验目的、原理和操作步骤,并能对实验进行评价和改进。
- 理解记忆,不死记硬背:对于化学方程式、物质性质等,要在理解其原理的基础上进行记忆,酸的通性本质上是H⁺的性质,碱的通性本质上是OH⁻的性质。
- 多做练习,总结规律:通过练习,巩固所学知识,特别是关于化学方程式的书写、溶质质量分数的计算、物质的鉴别与推断等综合性强的题目,要善于总结解题方法和规律。
- 联系生活实际:化学源于生活,又服务于生活,尝试用化学知识解释生活中的现象,如铁为什么会生锈、为什么可以用小苏打发酵面团、如何鉴别真假化肥等,这能极大激发学习兴趣。
希望这份详细的梳理对您有所帮助!祝您学习顺利!